一番よく出て、一番簡単です。
また、水溶性の危険物の数量=1個下の非水溶性の数量なので、
数字の流れを覚えて、問題用紙の余白に、覚えた表を書いて解きましょう。
(アルコール類は400Lとか)
重油 2000L → 倍数は2000L/2000L=1倍
ガソリン 200L→ 倍数は100L/200L=0.5
アルコール類 400L → 倍数 200L/400L=0.5倍
動植物油類 10000L →倍数 5000L/10000L =0.5倍
全部足して3倍です。
問題
液体10gの温度を20℃→50℃まであげるのに756Jの熱量を必要とした。この液体の比熱は何J/(g・K)か
解説
比熱は、物体1グラムの温度を1K上げるのに必要な熱量(J)です。
なので、比熱に、今見ている物質の重量と、上げたい温度をかけると熱量になります。
公式にすると 熱量(J) = 比熱(J/(g*K)) × 重量 (g) × 温度差(K)です。
ここで()の中の単位に着目すると、=の右側は比熱の分母にあるgとKが消えるので、=の左と単位が一緒になると思います。
このように、公式を覚えて無くても、=の左と右の単位が等しくなるように式を作れば公式を導くことができます。
が、難しければ、赤線の公式を覚えましょう。
問題文に書いてることを当てはめると
756(J(熱量)) = ○(比熱) × 10(g) × (50+273-(20+273)) (K)
(温度差なので、50-20と結果は一緒なのですが、温度差を見ない問題(ボイルシャルルの法則とか)で
K(ケルビン)に直し忘れるので、なれないうちは必ず℃→Kに直す癖をつけましょう。)
直すと
○(比熱) = 756 ÷ 10 ÷ 30 = 2.52
となりました。
③化学反応式の問題
プロパン22gを完全燃焼させる場合消費する酸素量は?
ただし、炭素の原子量を12、水素を1、酸素を6とする。
解説
化学反応式の問題はほぼ出るのですが、パターンが色々あるので少々面倒です。
ただし、以下の流れをマスターすれば必ず解けます。
①化学式を覚える。(優先度★★☆☆☆)
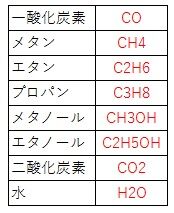
最小限上の表の化学式だけ覚えればいいです。
また、乙4だと、大体使う化学式は書いてるので、そこまで優先順は高くありません。
②化学反応式をたてる。(優先度★★★★★)
ここができると、化学反応式の計算問題のとっかかりができます。
反応式は
A,反応前後にできる物質を推定する。
B,反応前後の原子の数のつりあいが取れるように係数を考える。
ができれば、式を作れるのですが、
乙4で出る化学反応式は、ほとんど有機物の燃焼反応で、
燃やしたい物質 + O2(酸素) → CO2(二酸化炭素) + H2O(水)
になります。
なので、Aは考える必要がありません。Bができれば解けます。
ここからBの考え方を説明します。
問題③-1に必要なプロパンの燃焼の化学反応式を書きましょう
C3H8 + ◎O2 → △CO2 + □H2O
反応前 反応後
です。
係数はまだわからないので、◎、△、□としてます。
ここで
反応前の C、H、Oの数と反応後のC、H、Oの数は同じでないといけないです。
が、反応に関与するOの数を考えるには、△と□がわからないといけないので、
まずは、CとHのつりあいについて考えましょう
反応前 → 反応後
C : 3 → △×1
H : 8 → □×2
なので、反応前と反応後のCとHの数が同じになるには
△ = 3 ÷ 1 = 3
□ = 8 ÷ 2 = 4
になります。
ここまでわかったので◎をOのつりあいから同じように求めます。
反応前 → 反応後
O : 2×◎ △(3)×2 + □(4) × 1
です。
なので◎ = (3×2 + 4×1)/2=5
になりました。
反応式は
C3H8 + 5O2 → 3CO2 + 4H2O
です。
③出したい物質の数量を計算する。(優先度★★★★☆)
最後に反応する酸素の重量を出します。
反応式はC3H8 + 5O2 → 3CO2 + 4H2Oなので、C3H8 1(モル)に対し、酸素は5(モル)反応します。
なので、問題文のC3H8は何モルかについては、
C3H8は1モルで、3×12 + 1×8 = 44(g)になります。
問題文は22gのときなので、22/44=0.5モルのときに反応する酸素の量を計算します。
C3H81モルに対し、酸素は5モル反応するので、問題では0.5×5=2.5モル反応します。
酸素は1モル16×2=32なので
32×2.5=80(g)
が答えです。
問題③-2
次の示性式で表される物質1molを完全燃焼させた場合、必要な酸素量がもっとも多いものを選べ。
1.C3H7OH
2.CH3COCH3
3.C2H5OC2H5
4.CH3COC2H5
5.CH3COOC2H5
解説
難しい化学式が並んでますが、実は③-1より簡単で、③-1の
②化学反応式をたてる。(優先度★★★★★)
ができれば解けます。
1のC3H7OHの反応式を書きます。
C3H7OH + ◎O2 → △CO2 + □H2O
各元素のつりあいを立てると、
反応前 反応後
C : 3 △×1
H : 7+1 □×2
O : 1+◎×2 △×2+□×1
③-1と同じように出すと、△=3、□=4、◎=9/2
同様に他の選択肢も△、□、◎を出すと
2: △=3、□=3、◎=4
3: △=4、□=5、◎=6
4: △=4、□=5、◎=9/2
5: △=4、□=5、◎=5
です。
酸素量は◎なので、一番大きいのは③番の6になります。



コメント